Prometic annonce des données cliniques positives provenant de son étude clinique en cours pour les patients atteints du syndrome d'Alström English
- Observation d'avantages cliniques au niveau du cœur et du foie chez les patients traités avec le PBI-4050 sur une période moyenne de traitement de 52 semaines
- IRM cardiaque indique que le PBI-4050 a renversé la tendance de progression de la fibrose
- Réduction de la fibrose hépatique chez les patients traités avec le PBI-4050 démontrée à l'aide d'IRM et de Fibroscan
- Rencontres à venir avec la FDA et EMA afin de définir la voie réglementaire clinique du PBI-4050 pour le traitement du syndrome d'Alström
LAVAL, QC, le 28 mars 2018 /CNW Telbec/ - Prometic Sciences de la Vie Inc. (TSX: PLI) (OTCQX: PFSCF) (« Prometic ») a annoncé aujourd'hui de nouvelles données cliniques provenant de son étude clinique ouverte de phase 2 en cours au Royaume-Uni examinant l'utilisation du PBI-4050 pour le traitement des patients atteints du syndrome d'Alström.
L'étude clinique ayant recruté jusqu'à présent 12 patients, a rapporté que l'activité clinique et la tolérabilité du PBI-4050 sont maintenues lors de traitements prolongés. La durée moyenne de traitement du PBI-4050 pour les 12 patients a maintenant atteint 52 semaines et de l'activité clinique additionnelle au niveau du cœur et du foie a été constatée lors de traitements prolongés.
« La fibrose cardiaque progressive est la caractéristique la plus sérieuse du syndrome d'Alström et l'insuffisance cardiaque qui en résulte en est la principale cause de mortalité », a mentionné le Dr John Moran, Chef de la direction médicale de Prometic. « Ainsi, les résultats observés avec l'IRM cardiaque sont très prometteurs et dépassent nos attentes. Lorsque nous avons débuté l'étude, nous avions l'espoir de voir un ralentissement de la progression, mais nous avons plutôt constaté une régression de la fibrose cardiaque. De plus, l'IRM du foie supporte aussi les données du fibroscan et la réduction de la fibrose observée chez ces patients. Il faut aussi noter que l'activité clinique du PBI-4050 et la tolérabilité ont été aussi confirmées lors de cette période prolongée sans évènement adverse sérieux reliés à l'administration du médicament. L'activité clinique observée chez ces patients nous procure une confiance supplémentaire concernant l'étude clinique pivot de phase 3 à venir chez les patients atteints de fibrose pulmonaire idiopathique ».
Selon Pierre Laurin, Président et chef de la direction de Prometic : Une rencontre cet été avec les autorités réglementaires européennes et américaines est prévue afin de déterminer la voie réglementaire clinique pour ce traitement exploratoire chez les patients Alström qui ont sérieusement besoin d'un traitement anti-fibrotique. Il s'agit d'une étape critique afin de déterminer si cette maladie pédiatrique ultra-rare pourrait devenir une indication pouvant obtenir un statut de revue prioritaire ».
Résumé des données cardiaques
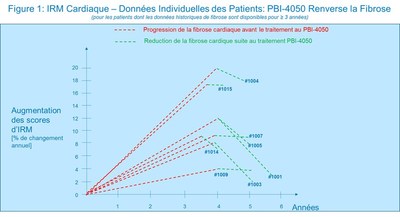
L'analyse des données de l'IRM cardiaque intérimaire indique une diminution de la fibrose cardiaque dans chaque patient après le début des traitements à l'aide du PBI-4050 (p<0.001). L'image 1 ci-jointe illustre la progression de la fibrose cardiaque exprimée en pourcentage d'augmentation de valeur IRM pour chaque patient pour qui trois (3) années ou plus de données étaient disponibles, et le renversement de la dite progression lorsque les patients sont traités à l'aide du PBI-4050. La longueur des lignes rouges pointillées correspond à la durée des données sur la fibrose et la longueur des lignes vertes pointillées à la durée du traitement de chaque patient à l'aide du PBI-4050
Résumé des données hépatiques
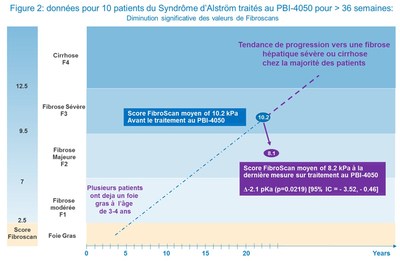
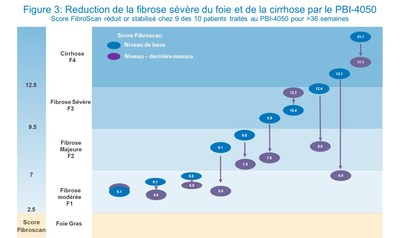
Les résultats du Fibroscan chez les 10 sujets ayant reçu un minimum de 36 semaines de traitements ont démontré une amélioration statistiquement significative dans la mesure de la rigidité du foie, d'une moyenne de 10.2 kPa à la ligne de référence à une moyenne de 8.1 kPa lors de la dernière prise de mesure, une diminution absolue de 2 kPa (p = 0.0219, 95% CI -3.52, -0.46) (figure 2). Les valeurs de fibroscan ont été réduites ou stabilisées chez 9 des 10 patients ayant été traités avec le PBI-4050 pendant ≥ 36 semaines (figure 3). Fibroscan est une technique non-invasive pour l'évaluation clinique de la fibrose hépatique avec un haut degré de précision et de reproductibilité, spécialement chez les patients ayant une fibrose établie (≥ F2) (Cassinotto 2016).
De plus, les données IRM du foie ont aussi indiqué une diminution moyenne de -11 % dans la valeur corrigée T1 entre la ligne de référence et la dernière prise de donnée (p=0.0195, 95% CI: -92.3, -9.8), ce qui supporte une amélioration de la fibrose hépatique.
Des effets positifs sur d'autres paramètres du foie ont aussi été observés et seront divulgués au Congrès international du foie 2018, la rencontre annuelle de l'Association européenne pour l'étude du foie (EASL), devant avoir lieu à Paris, du 11 au 15 avril 2018.
À propos du syndrome d'Alström
Le syndrome d'Alström est un syndrome héréditaire autosomique récessif rare caractérisé par l'apparition de l'obésité lors de l'enfance et de l'adolescence, du diabète de type 2 avec une sévère résistance à l'insuline, une dyslipidémie, de l'hypertension et une fibrose sévère dans plusieurs organes, dont le foie, les reins et le cœur.
Le syndrome d'Alström est aussi caractérisé par une perte de vision et d'audition progressive, une forme de maladie cardiaque élargissant et affaiblissant le muscle cardiaque (myocardiopathie dilatée) et par une petite taille. Cette maladie peut aussi causer de sérieux problèmes médicaux potentiellement fatals impliquant le foie, les reins, la vessie et les poumons. Certains des individus souffrant du syndrome d'Alström ont une condition de la peau connue sous le nom de d'acanthoses nigricans, causant des plis dans la peau d'apparence foncée, épaisse et veloutée. Les signes et symptômes du syndrome d'Alström varient en sévérité et ce ne sont pas tous les individus affectés qui démontrent toutes les caractéristiques de la maladie.
À propos du PBI-4050
Le PBI-4050 est l'un des médicaments candidats oralement actif avec un profil d'innocuité et une efficacité démontrée dans plusieurs expériences in vivo ciblant la fibrose. La fibrose est un processus complexe par lequel l'inflammation continuelle cause une perte de fonctionnalité chez certains organes vitaux alors que les tissus normaux sont remplacés par des tissus cicatriciels fibreux. Les données concernant la preuve de concept générée jusqu'à présent confirment l'activité anti-fibrotique de nos principaux médicaments candidats dans plusieurs des principaux organes incluant les reins, le cœur, les poumons et le foie. 26 millions de patients aux États-Unis seulement souffrent de maladies rénales chroniques. Les patients ayant de graves maladies rénales (stades 3 et 4) souffrent d'une perte graduelle et accélérée de leurs fonctions rénales (maladies rénales terminales) menant au besoin d'hémodialyse. Les complications cardio-vasculaires pour les patients ayant des maladies rénales terminales et dialysées sont une cause fréquente de décès.
À propos de Prometic Sciences de la Vie Inc.
Prometic (la « Société ») est une société biopharmaceutique qui dispose de deux plateformes de découverte de médicaments axées sur les besoins médicaux insatisfaits dans le domaine de la fibrose et maladies orphelines. La première plateforme, celle des produits thérapeutiques à base de petites molécules, fait suite à la découverte de deux récepteurs GPR40/GPR84 agissant comme doubles interrupteurs principaux qui sont à la base du processus de guérison plutôt que la fibrose. La seconde plateforme est celle des produits thérapeutiques dérivés du plasma; elle tire profit de la grande expertise de Prometic dans les technologies de bioséparation afin de répondre à des besoins médicaux insatisfaits au moyen de protéines thérapeutiques qui ne sont actuellement pas accessibles sur le marché, comme RyplazimMD (plasminogène humain). La Société tire aussi parti du taux supérieur de récupération de cette plateforme pour certains produits thérapeutiques reconnus dont la demande est en pleine croissance, comme l'immunoglobuline intraveineuse (IgIV) et met ses technologies exclusives de bioséparation à la disposition des sociétés pharmaceutiques qui produisent des agents biopharmaceutiques n'entrant pas en concurrence avec ses propres produits. Reconnue mondialement comme un chef de file en bioséparation, la Société encaisse des revenus grâce à la vente de produits de chromatographie d'affinité, ces revenus lui permettant de compenser le coût de ses propres investissements en recherche et développement. Ayant son siège social à Laval (Québec, Canada), la Société dispose d'installations de recherche et développement au Canada, au Royaume-Uni et aux États-Unis ainsi que d'installations de fabrication au Canada et à l'île de Man; ses activités commerciales et de développement des affaires se déroulent au Canada, aux États-Unis, en Europe et en Asie.
Énoncés prospectifs
Le présent communiqué renferme des énoncés prospectifs sur les objectifs, les stratégies et les activités de Prometic. Ces énoncés prospectifs sont assujettis à certains risques et incertitudes. Ces énoncés sont de nature « prospective » puisqu'ils sont fondés sur nos attentes présentes à l'égard des marchés dans lesquels nous exerçons nos activités et sur diverses estimations et hypothèses. Les événements ou les résultats réels sont susceptibles de différer considérablement de ceux prévus dans le cadre des énoncés prospectifs si des risques connus ou inconnus affectent nos activités ou si nos estimations ou nos hypothèses s'avèrent inexactes. Ces risques, estimations et hypothèses portent notamment sur la capacité de Prometic d'assurer le développement, la fabrication et la commercialisation de produits pharmaceutiques à valeur ajoutée et d'obtenir des contrats relatifs à ses produits et services, la disponibilité de ressources financières et autres pour compléter des projets de recherche et développement, le succès et la durée d'études cliniques, la capacité de Prometic de se prévaloir d'occasions d'affaires dans l'industrie pharmaceutique, les incertitudes liées au processus de réglementation et tout changement du contexte économique. Vous trouverez une analyse plus exhaustive des risques qui pourraient faire en sorte que les évènements ou résultats réels diffèrent de nos attentes présentes de façon importante dans la notice annuelle de Prometic pour l'année terminée le 31 décembre 2016, sous la rubrique « Risques et incertitudes reliés aux activités de Prometic ». Par conséquent, nous ne pouvons garantir la réalisation des énoncés prospectifs. Par ailleurs, nous ne nous engageons aucunement à mettre à jour ces énoncés prospectifs, même si de nouveaux renseignements devenaient disponibles, à la suite d'événements futurs ou pour toute autre raison, à moins d'y être tenus en vertu des lois et règlements applicables aux valeurs mobilières. Tous les montants sont en dollars canadiens sauf si précisé autrement.
SOURCE ProMetic Sciences de la Vie Inc.

Pierre Laurin, Président et chef de la direction, Prometic Sciences de la Vie inc., [email protected], +1-450-781-0115; Frédéric Dumais, Directeur principal, Communications et relations avec les investisseurs, Prometic Sciences de la Vie inc., [email protected], +1-450-781-0115

Partager cet article