Avis public - Des produits de santé non homologués ont été saisis chez le détaillant en ligne « UU Zone » parce qu'ils pourraient présenter de graves risques pour la santé English
MISE À JOUR : le 13 mars 2024 : Des produits de santé non autorisés additionnels saisis chez le détaillant en ligne « UU Zone » peuvent poser de graves risques pour la santé.
OTTAWA, ON, le 13 mars 2024 /CNW/ - À la suite de sa communication du 25 octobre 2023, Santé Canada met en garde les consommateurs contre d'autres produits de santé non autorisés saisis chez le détaillant en ligne UU Zone, situé à Markham, en Ontario. Ces produits sont étiquetés comme contenant des médicaments d'ordonnance, des médicaments contrôlés ou des médicaments en vente libre, et peuvent présenter de graves risques pour la santé.











La liste des produits saisis a été ajoutée au tableau des produits concernés ci-dessous. Des informations sur les risques pour la santé associés à ces médicaments ainsi que des informations destinées aux consommateurs sont disponibles ci-dessous.
25 octobre 2023 : Les produits de santé non autorisés saisis chez le détaillant en ligne « UU Zone » peuvent présenter de graves risques pour la santé
Résumé
- Produit : Produits de santé non homologués dont l'étiquette indique qu'ils contiennent un médicament d'ordonnance
- Problème : Produits de santé - Sécurité des produits; Produits non homologués
- Ce qu'il faut faire : N'utilisez pas ces produits. Ne vous procurez vos médicaments d'ordonnance que dans des pharmacies autorisées. Apportez les produits à votre pharmacie locale pour qu'ils soient éliminés convenablement. Consultez un professionnel de la santé si vous avez utilisé l'un de ces produits et que vous êtes inquiet pour votre santé. Lisez les étiquettes des produits de santé pour vous assurer que leur vente a été autorisée par Santé Canada.
Produits visés
Produit |
Usage prévu |
Médicament d'ordonnance mentionné sur l'étiquette |
Date de l'ajout |
Acnes25
|
Traitement contre l'acné |
Présence de pinocol d'ibuprofène 3 % indiquée sur l'étiquette. |
25 octobre 2023 |
Borraginol A |
Pommade hémorroïdaire |
Présence d'acétate de prednisolone indiquée sur l'étiquette. |
25 octobre 2023 |
Patch Daiichi Sankyo Healthcare Makiron |
Patch anti-démangeaison |
Présence de dexaméthasone indiquée sur l'étiquette. |
25 octobre 2023 |
Crème contre l'acné PAIR
|
Traitement contre l'acné |
Présence de pinocol d'ibuprofène 3 % indiquée sur l'étiquette. |
25 octobre 2023 |
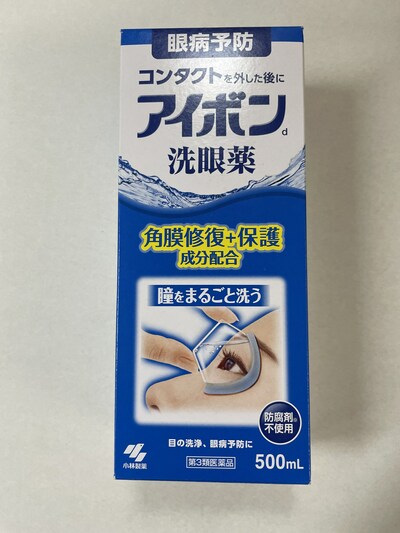
Rohto Digieye anti blue light eye drops (clear) |
Gouttes ophtalmiques |
Présence de méthylsulfate de néostigmine indiquée sur l'étiquette. |
25 octobre 2023 |
Rohto Digieye anti blue light eye drops (yellow) |
Gouttes ophtalmiques |
Présence de méthylsulfate de néostigmine indiquée sur l'étiquette. |
25 octobre 2023 |
Rohto Z! eye drops |
Gouttes ophtalmiques |
Présence de méthylsulfate de néostigmine indiquée sur l'étiquette. |
25 octobre 2023 |
Taisho Canker Sore Patch/Stomatitis patch Taisho Quick Care |
Patch contre les chancres pour les enfants de 5 ans et plus |
Présence d'acétonide de triamcinolone indiquée sur l'étiquette. |
25 octobre 2023 |
Rohto Z! Pro |
Gouttes ophtalmiques |
Présence de méthylsulfate de néostigmine indiquée sur l'étiquette. |
13 mars 2024 |
Sante Beauteye Moon Care |
Gouttes ophtalmiques |
Présence d'acide aminocaproïque indiquée sur l'étiquette. |
13 mars 2024 |
Sante PC Contact |
Gouttes ophtalmiques |
Présence de méthylsulfate de néostigmine indiquée sur l'étiquette. |
13 mars 2024 |
Kobayashi Eyewash (Vert/Turquoise)) |
Gouttes ophtalmiques |
Présence d'acide aminocaproïque indiquée sur l'étiquette. |
13 mars 2024 |
Sante 40 Plus |
Gouttes ophtalmiques |
Présence de méthylsulfate de néostigmine indiquée sur l'étiquette. |
13 mars 2024 |
Kobayashi AL Eyewash (Vert) |
Gouttes ophtalmiques |
Présence d'acide aminocaproïque indiquée sur l'étiquette. |
13 mars 2024 |
Kobayashi Eyewash (Bleu) |
Gouttes ophtalmiques |
Présence d'acide aminocaproïque indiquée sur l'étiquette. |
13 mars 2024 |
Sante PC |
Gouttes ophtalmiques |
Présence de méthylsulfate de néostigmine indiquée sur l'étiquette. |
13 mars 2024 |
Rohto Koukin Antibacterial Eyedrop |
Gouttes ophtalmiques |
Présence d'acide aminocaproïque indiquée sur l'étiquette. |
13 mars 2024 |
Sante Beauteye Contact |
Gouttes ophtalmiques |
Présence de méthylsulfate de néostigmine indiquée sur l'étiquette. |
13 mars 2024 |
Taisho Pabron Gold A Granules Cold Medication |
Médicament contre le rhume |
Présence de phosphate de dihydrocodéine et d'acétaminophène indiquée sur l'étiquette. |
13 mars 2024 |
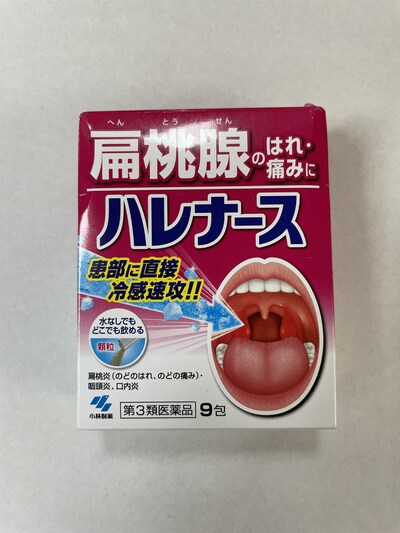
Kobayashi Harenasu Medicine for Throat Pain and Swelling |
Médicament contre le rhume |
Présence d'acide tranexamique indiquée sur l'étiquette |
13 mars 2024 |
Santé Canada avise les consommateurs que des produits non autorisés ont été saisis chez le détaillant en ligne UU Zone, situé à Markham (Ontario). Ces produits, dont l'étiquette indique la présence de médicaments, pourraient présenter de graves risques pour la santé.
La vente de produits de santé non homologués au Canada est illégale. Les produits de santé non homologués n'ont pas été autorisés par Santé Canada, ce qui signifie que leur innocuité, leur efficacité et leur qualité n'ont pas été évaluées et qu'ils peuvent présenter de graves risques pour la santé. À titre d'exemple, ils peuvent contenir des ingrédients à risque élevé (comme des médicaments d'ordonnance, des additifs ou des contaminants) dont la présence pourrait ne pas être indiquée sur l'étiquette. Ces ingrédients pourraient interagir avec d'autres médicaments et aliments. De plus, ces produits pourraient ne pas vraiment contenir les ingrédients actifs auxquels les consommateurs s'attendent pour aider au maintien ou à l'amélioration de leur santé.
Les médicaments d'ordonnance ne doivent être utilisés que sous la supervision d'un professionnel de la santé, car ils sont utilisés pour traiter des problèmes de santé précis et peuvent causer des effets secondaires graves. Les médicaments d'ordonnance ne peuvent être vendus légalement aux consommateurs canadiens qu'avec une ordonnance.
Ce que vous devriez faire
- N'utilisez pas ces produits. Rapportez-les à votre pharmacie du coin pour qu'ils soient éliminés convenablement.
- Consultez un professionnel de la santé si vous avez utilisé n'importe lequel de ces produits et que vous avez des préoccupations relatives à votre santé.
- Ne vous procurez vos médicaments d'ordonnance que dans des pharmacies autorisées.
- Lisez l'étiquette des produits de santé pour vérifier si Santé Canada en a autorisé la vente. Les produits homologués ont un code d'identification numérique de huit chiffres, soit un numéro d'identification du médicament (DIN), un numéro de produit naturel (NPN) ou un numéro de médicament homéopathique (DIN-HM). Vous pouvez aussi vérifier si la vente de produits a été autorisée en effectuant une recherche dans la Base de données sur les produits pharmaceutiques et dans la Base de données des produits de santé naturels homologués.
- Signalez à Santé Canada tout effet indésirable lié à un produit de santé ou toute plainte concernant un de ces produits.
Contexte :
L'acide aminocaproïque est un médicament délivré sur ordonnance utilisé pour réduire les saignements dans diverses situations cliniques. L'exposition à l'acide aminocaproïque dans l'œil peut affecter l'œil lui-même et l'acide peut être absorbé par les canaux lacrymaux dans le sang. Les effets secondaires peuvent inclure des larmoiements, des changements de vision, des maux de tête, des vertiges, des nausées, des faiblesses musculaires et des éruptions cutanées.
La dexaméthasone est un corticostéroïde d'ordonnance disponible au Canada dans diverses préparations et utilisée pour traiter les maladies inflammatoires. Son utilisation dans les crèmes n'a pas été approuvée au Canada. Parmi les effets secondaires courants des corticostéroïdes topiques, mentionnons la rougeur de la peau, la sensation de brûlure, les changements de pigmentation de la peau, l'atrophie de la peau (p. ex. peau fragile, avec une réduction de l'élasticité), les changements des vaisseaux sanguins de la peau (p. ex. télangiectasie en araignée), le changement de la couleur de la peau, les vergetures, l'enflure, la peau sèche, la sensation de brûlure, l'irritation locale, les éruptions cutanées, les rougeurs, les démangeaisons, l'amincissement des cheveux ou la croissance excessive des cheveux, les infections et les réactions allergiques. Les corticostéroïdes topiques absorbés par la peau peuvent causer des effets secondaires dans tout le corps, surtout lorsqu'elle est utilisée sur une grande surface et pendant longtemps. Ce risque est plus élevé chez les enfants, qui peuvent absorber des quantités proportionnellement plus importantes et être plus sensibles aux effets secondaires. Les effets secondaires systémiques peuvent comprendre l'hypertension artérielle, l'hyperglycémie, une vision floue, des battements cardiaques inégaux, de la faiblesse et de l'enflure. La dexaméthasone ne doit pas être utilisée par des personnes allergiques à la dexaméthasone ou à tout ingrédient de la préparation, par des personnes qui ont des infections fongiques généralisées ou par des personnes qui ont reçu des vaccins à virus vivant. La dexaméthasone n'est généralement pas recommandée pendant la grossesse.
Le phosphate de dihydrocodéine est une substance réglementée en vertu de la Loi réglementant certaines drogues et autres substances et est similaire à l'opioïde codéine. Bien que la codéine soit approuvée au Canada, Santé Canada n'a autorisé aucun produit pharmaceutique contenant de la dihydrocodéine. Les comprimés de dihydrocodéine sont approuvés dans certains pays pour le soulagement de la douleur sévère et chronique ou comme antitussifs. Les effets indésirables les plus fréquents sont les étourdissements, les maux de tête, les vertiges, les troubles visuels, la confusion, l'euphorie, les nausées et la constipation. Comme pour tous les opioïdes, l'utilisation de la dihydrocodéine peut entraîner une dépendance. La dihydrocodéine peut provoquer un ralentissement ou un arrêt de la respiration, ce qui peut entraîner une somnolence grave, une perte de conscience et la mort (surdose d'opioïdes). Les personnes souffrant d'autres pathologies, y compris, mais sans s'y limiter, celles qui affectent les poumons, le foie ou les reins, peuvent présenter un risque plus élevé d'overdose. Les enfants sont plus susceptibles d'être victimes d'une overdose en raison de leur petite taille. La dihydrocodéine ne doit pas être utilisée par les femmes enceintes ou qui allaitent, ni par les personnes allergiques à la dihydrocodéine. L'utilisation de la dihydrocodéine avec d'autres dépresseurs du système nerveux central (par exemple, l'alcool, les somnifères, etc.) peut aggraver ses effets. En cas de surdosage, la naloxone peut temporairement inverser les effets de la dihydrocodéine.
Le piconol d'ibuprofène 3 % est un médicament topique (appliqué sur la peau) anti-inflammatoire non stéroïdien (AINS) utilisé pour le soulagement des brûlures. Santé Canada n'a approuvé aucun médicament contenant de l'ibuprofène pour une application topique. L'ibuprofène absorbé par la peau peut causer des effets secondaires partout dans le corps, surtout lorsqu'il est appliqué sur une grande surface et pour une longue période, ou sur une peau endommagée. L'ibuprofène topique peut engendrer de sérieux effets secondaires chez les personnes qui sont allergiques à l'ibuprofène, à l'aspirine ou aux autres AINS, qui sont asthmatiques, ou qui souffrent d'écoulements nasaux ou d'urticaire. L'utilisation de l'ibuprofène topique peut aussi causer de sérieux effets secondaires chez les personnes ayant des problèmes cardiovasculaires, rénaux (reins) et gastro-intestinaux, tels que des hémorragies gastro-intestinales, des dysfonctionnements ou des insuffisances rénaux, ou encore des dysfonctionnements ou des défaillances cardiovasculaires. L'ibuprofène topique peut aussi causer de sérieux effets secondaires chez les personnes enceintes ou qui allaitent, tels que des accouchements retardés ou de plus longue durée.
Le méthylsulfate de néostigmine est un médicament d'ordonnance vendu au Canada sous forme d'injection servant à prévenir et à traiter la rétention d'urine et les complications intestinales après une intervention chirurgicale; à inverser l'effet paralysant de certains médicaments utilisés en chirurgie et en sismothérapie; et à contrôler les symptômes de la myasthénie grave (une maladie qui provoque une faiblesse des muscles squelettiques). Son utilisation sous forme de gouttes oculaires n'a pas été approuvée au Canada. Par le passé, des médicaments semblables à la néostigmine étaient utilisés pour traiter le glaucome, un groupe d'affections oculaires habituellement caractérisées par une pression élevée à l'intérieur de l'œil. Ces médicaments ne sont plus utilisés à grande échelle en raison du nombre important d'effets secondaires possibles liés aux yeux, notamment une vision éloignée trouble, des maux de tête frontaux, des spasmes des paupières, des yeux rouges, des cataractes (embrouillement du cristallin de l'œil, lequel est normalement transparent), des réactions allergiques, des kystes de l'iris, un décollement de la rétine avec une acuité visuelle réduite, l'apparition soudaine de points lumineux ou de corps flottants pouvant entraîner une perte de vision permanente, et la probabilité d'une crise de glaucome d'un type particulier, avec une possible perte de vision permanente. Ils peuvent en outre entraîner de graves effets secondaires cardiaques ou respiratoires s'ils sont absorbés dans le nez en passant par les conduits lacrymaux.
L'acétate de valérate de prednisolone est un corticostéroïde d'ordonnance offert au Canada sous forme de gouttes oculaires utilisées pour traiter l'inflammation de plusieurs parties de l'œil. Son utilisation dans les crèmes ou les onguents n'a pas été approuvée au Canada. Parmi les effets secondaires courants des corticostéroïdes topiques, mentionnons l'atrophie de la peau (peau mince et fragile avec réduction de l'élasticité), les changements des vaisseaux sanguins de la peau (p. ex. télangiectasie en araignée), les changements de la couleur de la peau, les vergetures, l'enflure, la peau sèche, la sensation de brûlure, l'irritation locale, les éruptions cutanées, les rougeurs, les démangeaisons, l'amincissement des cheveux ou la croissance excessive des cheveux, les infections et les réactions allergiques. Les corticostéroïdes topiques absorbés par la peau peuvent causer des effets secondaires dans tout le corps, surtout lorsqu'ils sont utilisés sur une grande surface et pendant longtemps. Ce risque est plus élevé chez les enfants, qui peuvent absorber des quantités proportionnellement plus importantes et être plus sensibles aux effets secondaires. Les effets secondaires systémiques peuvent comprendre l'hypertension artérielle, l'hyperglycémie, une vision trouble, des battements cardiaques inégaux, de la faiblesse et de l'enflure. L'acétate de valérate de prednisolone ne doit pas être utilisé par des personnes allergiques à l'acétate de prednisolone ou à tout ingrédient de la préparation. L'acétate de valérate de prednisolone ne doit pas être utilisé chez les enfants et son utilisation n'est pas recommandée pendant la grossesse ou l'allaitement.
L'acide tranexamique est un médicament délivré sur ordonnance utilisé pour prévenir ou réduire les saignements en ralentissant la décomposition des caillots sanguins. Le médicament est généralement administré par voie orale ou intraveineuse. L'acide tranexamique doit être utilisé avec prudence avec les anticoagulants et les anti-inflammatoires, l'œstrogénothérapie, les médicaments utilisés pour favoriser la coagulation du sang, les pilules contraceptives, l'hydrochlorothiazide, la desmopressine, la ranitidine ou la nitroglycérine.
L'acétonide de triamcinolone est un corticostéroïde d'ordonnance disponible au Canada sous forme de crème topique, d'onguent et de pâte dentaire, et est utilisé pour traiter les maladies inflammatoires. L'utilisation de l'acétonide de triamcinolone sous forme de timbre n'a pas été approuvée au Canada. Parmi les effets secondaires courants des corticostéroïdes topiques, mentionnons l'atrophie de la peau (peau mince et fragile avec réduction de l'élasticité), les changements des vaisseaux sanguins de la peau (p. ex. télangiectasie en araignée), le changement de la couleur de la peau, les vergetures, l'enflure, la peau sèche, la sensation de brûlure, l'irritation locale, les éruptions cutanées, les rougeurs, les démangeaisons, les infections et les réactions allergiques. Les corticostéroïdes topiques absorbés par la peau ou par la bouche peuvent causer des effets secondaires dans tout le corps, surtout lorsqu'elle est utilisée sur une grande surface et pendant longtemps. Ce risque est plus élevé chez les enfants, qui peuvent absorber des quantités proportionnellement plus importantes et être plus sensibles aux effets secondaires. Les effets secondaires systémiques peuvent comprendre l'hypertension artérielle, l'hyperglycémie, une vision floue, des battements cardiaques inégaux, de la faiblesse, de l'enflure, la suppression des glandes surrénales et l'aggravation d'un ulcère de l'estomac. L'acétonide de triamcinolone ne doit pas être utilisé par les personnes allergiques à l'acétate de triamcinolone ou à tout ingrédient de la préparation, les personnes qui ont des infections bactériennes ou fongiques non traitées qui touchent la peau, les personnes qui ont des infections fongiques, virales ou bactériennes de la bouche ou de la gorge, les personnes atteintes de tuberculose, d'ulcères d'estomac ou de diabète sucré, et les personnes atteintes de certaines maladies virales comme l'herpès simplex ou la varicelle. L'utilisation de l'acétonide de triamcinolone comme pâte dentaire doit être interrompue en cas d'irritation locale. L'utilisation de l'acétonide de triamcinolone n'est pas recommandée pendant la grossesse ou l'allaitement.
Also available in English
SOURCE Santé Canada (SC)

Renseignements aux médias : Santé Canada, (613) 957-2983, [email protected] ; Renseignements au public : (613) 957-2991, 1-866 225-0709, [email protected]
Partager cet article